03.com.ua- свободная медицинская энциклопедия. Каждый зарегистрированый участник может редактировать статьи
Пептидная связь: различия между версиями
Перейти к навигации
Перейти к поиску
Root (обсуждение | вклад) (Новая: '''Пептидная связь''' — вид амидной связи, возникающей при образовании белков и [[пептиды|пепти...) |
Root (обсуждение | вклад) |
||
| Строка 1: | Строка 1: | ||
| − | '''Пептидная связь''' — вид амидной связи, возникающей при образовании [[ | + | '''Пептидная связь''' — вид амидной связи, возникающей при образовании [[белки|белков]] и [[пептиды|пептидов]] в результате взаимодействия α-аминогруппы (-NH<SUB>2</SUB>) одной [[аминокислота|аминокислоты]] с α-карбоксильной группой (-СООН) другой аминокислоты. |
== Свойства пептидной связи == | == Свойства пептидной связи == | ||
Текущая версия на 17:54, 1 ноября 2007
Пептидная связь — вид амидной связи, возникающей при образовании белков и пептидов в результате взаимодействия α-аминогруппы (-NH2) одной аминокислоты с α-карбоксильной группой (-СООН) другой аминокислоты.
Свойства пептидной связи
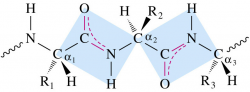
Связь C-N в пептидной связи частично имеет характер двойной, что проявляется, в частности, в уменьшении её длины до 1,32 ангстрема. Также это обуславливает следующие свойства:
- 4 атома связи (C, N, O и H) и 2 α-углерода находятся в одной плоскости. R-группы аминокислот и водороды при α-углеродах находятся вне этой плоскости.
- H и O в пептидной связи, а также α-углероды двух аминокислот трансориентированы (транс-изомер более устойчив). В случае L-аминокислот, что имеет место во всех природных белках и пептидах, R-группы также трансориентрованы.
- Вращение вокруг связи C-N невозможно, возможно вращение вокруг С-С связи
Ссылки
.,ll/..,/.