03.com.ua- свободная медицинская энциклопедия. Каждый зарегистрированый участник может редактировать статьи
Рибосома
Рибосома — важнейший органоид живой клетки сферической или слегка овальной формы, диаметром 100-200 ангстрем, состоящий из большой и малой субъединиц. Рибосомы служат для биосинтеза белка из аминокислот по заданной матрице на основе генетической информации, предоставляемой матричной РНК, или мРНК. Этот процесс называется трансляцией.
В эукариотических клетках рибосомы располагаются на мембранах эндоплазматического ретикулума, хотя могут быть локализованы и в неприкрепленной форме в цитоплазме. Нередко с одной молекулой мРНК ассоциировано несколько рибосом, такая структура называется полирибосомой. Синтез рибосом у эукариот происходит в специальной внутриядерной структуре - ядрышке.
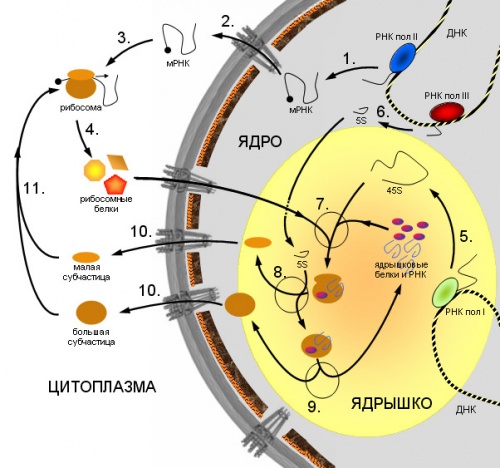
1. Синтез мРНК рибосомных белков РНК полимеразой II. 2. Экспорт мРНК из ядра. 3. Узнавание мРНК рибосомой и 4. синтез рибосомных белков. 5. Синтез предшественника рРНК (45S - предшественник) РНК полимеразой I. 6. Синтез 5S pРНК РНК полимеразой III. 7. Сборка большой рибонуклеопротеидной частицы, включающей 45S-предшественник, импортированные из цитоплазмы рибосомные белки, а также специальные ядрышковые белки и РНК, принимающие участие в созревании рибосомных субчастиц. 8. Присоединение 5S рРНК, нарезание предшественника и отделение малой рибосомной субчастицы. 9. Дозревание большой субчастицы, высвобождение ядрышковых белков и РНК. 10. Выход рибосомных субчастиц из ядра. 11. Вовлечение их в трансляцию.
Рибосомы представляют собой нуклеопротеид, в составе которого отношение РНК/белок составляет 1:1 у высших животных и 60-65:35-40 у бактерий. Рибосомная РНК составляет около 70 % всей РНК клетки. Рибосомы эукариот включают четыре молекулы рРНК, из них 18S, 5.8S и 28S рРНК синтезируются в ядрышке РНК полимеразой I в виде единого предшественника (45S), который затем подвергается модификациям и нарезанию. 5S рРНК синтезируется РНК полимеразой III в другой части генома и не нуждаются в дополнительных модификациях. Почти вся рРНК находится в виде магниевой соли, что необходимо для поддержания структуры; при удалении ионов магния рибосома подвергается диссоциации на субъединицы.
Константа седиментации (скорость оседания в ультрацентрифуге) рибосом эукариотических клеток равняется 80S (большая и малая субъединицы 60S и 40S, соответственно), бактериальных клеток (а так же митохондрий и пластид) — 70S (большая и малая субъединицы 50S и 30S, соответственно).
История исследований рибосомы
Рибосомы впервые были описаны как уплотненные частицы, или гранулы, клеточным биологом румынского происхождения Джорджем Паладе в середине 1950-х годов <ref> G.E. Palade. (1955) "A small particulate component of the cytoplasm." J Biophys Biochem Cytol. Jan;1(1): pages 59-68. PMID 14381428</ref>. В 1974 г. Паладе, Клод и Кристиан Де Дюв получили Нобелевскую премию по физиологии и медицине «за открытия, касающиеся структурной и функциональной организации клетки». Термин "рибосома" был предложен Ричардом Робертсом в 1958 вместо "рибонуклеобелковая частица микросомальной фракции" <ref> Roberts, R. B., editor. (1958) "Introduction" in Microsomal Particles and Protein Synthesis. New York: Pergamon Press, Inc.</ref>. Биохимические и мутационные исследования рибосомы начиная с 1960-х позволили описать многие функциональные и структурные особенности рибосомы. В начале 2000-х появились атомные структуры отдельных субъединиц, а также полной рибосомы, связанной с различными субстратами, которые позволили понять механизм декодинга (распознавания антикодона тРНК, комплементарного кодону мРНК) и детали взаимодействий между рибосомой, антибиотиками, тРНК и мРНК.
Механизм трансляции
Трансляция - синтез белка рибосомой на основе информации, записанной в матричной РНК (мРНК). мРНК связывается с малой субъединицей рибосомы, когда происходит узнавание 3'-концом 16S рибосомной РНК комплементарной последовательности Шайн-Далгарно, расположенной на 5'-конце мРНК (у прокариот), а также позиционирование стартового кодона (как правило, AUG) мРНК на малой субъединице. Ассоциация малой и большой субъединиц происходит при связывании формилметионил-тРНК (fMET-тРНК) и участии факторов инициации (IF1, IF2 и IF3 у прокариот; их аналоги и дополнительные факторы участвуют в инициации трансляции у эукариотических рибосом). Таким образом, распознавание антикодона (в тРНК) происходит на малой субъединице.
После ассоциации, fMET-тРНК оказывается в P (peptidyl-) центре рибосомы. Следующая тРНК, несущая на 3'-конце аминокислоту, и комплементарная второму кодону на мРНК, связывается с помощью фактора EF-Tu на А (аминоацил-) центре рибосомы. Затем, на большой субъединице, в пептидил-трансферазном центре рибосомы, образуется пептидная связь между формилметионином (связанным с тРНК, находящейся в Р-центре) и аминокислотой, находящейся в А-центре. По поводу деталей механизма катализа образования пептидной связи в пептидил-трансферазном центре консенсус до сих пор не достигнут. На данный момент существует несколько гипотез механизма катализа рибосомой: 1. оптимальное позиционирование субстратов (induced fit)<ref> Sievers A, Beringer M, Rodnina MV, Wolfenden R. The ribosome as an entropy trap. Proc Natl Acad Sci U S A. 2004 May 25;101(21):7897-901.</ref>, 2. исключение из активного центра воды, способной прервать образование пептидной цепи посредством гидролиза <ref>T.M. Schmeing, K.S. Huang, S.A. Strobel and T.A. Steitz, An induced-fit mechanism to promote peptide bond formation and exclude hydrolysis of peptidyl-tRNA. Nature 438 (2005), pp. 520–524.</ref>, 3. участие нуклеотидов рРНК (таких как А2450 и А2451) в переносе протона<ref>A.E. Hesslein, V.I. Katunin, M. Beringer, A.B. Kosek, M.V. Rodnina and S.A. Strobel, Exploration of the conserved A+C wobble pair within the ribosomal peptidyl transferase center using affinity purified mutant ribosomes, Nucleic Acids Res. 32 (2004), pp. 3760–3770.</ref><ref>P. Nissen, J. Hansen, N. Ban, P.B. Moore and T.A. Steitz, The structural basis of ribosome activity in peptide bond synthesis, Science 289 (2000), pp. 920–930.</ref>, 4. участие 2'-гидроксильной группы 3'-концевого нуклеотида тРНК (А76) в переносе протона <ref>T.M. Schmeing, K.S. Huang, D.E. Kitchen, S.A. Strobel and T.A. Steitz, Structural insights into the roles of water and the 2′ hydroxyl of the P site tRNA in the peptidyl transferase reaction, Mol. Cell 20 (2005), pp. 437–448</ref>; а также комбинации этих механизмов.
После образования пептидной связи, полипептид оказывается связанным с тРНК, находящейся в А-центре. Следующим шагом является движение деацилированной тРНК из Р- в Е (exit-) центр, а пептидил-тРНК из А- в Р-центр. Этот процесс называется транслокация и происходит с помощью фактора EF-G. тРНК, комплементарная следующему кодону мРНК, связывается с А-центром рибосомы, что ведет к повторению описанных шагов. Стоп-кодоны (UGA, UAG и UAA) сигнализируют об окончании трансляции. Обрыв полипептидной цепи и диссоциация субъединиц (для приготовления к связыванию следующей мРНК и синтезу соответствующего белка) происходит при участии факторов (RF1, RF2, RF3, RRF в прокариотах).
Ссылки
Внешние ссылки
Сайт одного из ведущих учёных по исследованию структуры рибосом, содержит большое количество иллюстраций, в том числе анимированных [1] Шаблон:Ref-en