03.com.ua- свободная медицинская энциклопедия. Каждый зарегистрированый участник может редактировать статьи
Белки
Белки́ (протеины) — сложные высокомолекулярные природные органические вещества, построенные из аминокислот, соединённых пептидными связями (т.е. белки - это линейные полимеры аминокислот). Последовательность аминокислот в белке определена геном и зашифрована в генетическом коде. Хотя на первый взгляд может показаться, что наличие «всего» 20 видов аминокислот ограничивает разнообразие белковых структур, на самом деле количество вариантов трудно переоценить: для цепочки всего из 5 аминокислот оно составляет уже более 3 миллионов, а цепочка из 100 аминокислот (небольшой белок) может быть представлена более чем в 10130 вариантах. Для выполнения определённой функции зачастую требуется совместное участие нескольких разных белков. Белки часто связываются, формируя стабильные комплексы. Определениe аминокислотной последовательности первого белка, инсулина, методом секвенирования белков принесло Фредерику Сэнгеру Нобелевскую премию в 1958 году. Первые трёхмерные структуры белков - гемоглобина и миоглобина - были разрешены методом дифракции рентгеновских лучей, соответственно, Максом Перутцем и Джоном Кендрю в 1958 году, за что в 1962 они получили Нобелевскую премию по химии.
Содержание
История изучения
Название «протеин» (синоним «белку») происходит от Шаблон:Lang-el; («прота»), то есть — «главным образом важности». Белки были выделены в отдельный класс биологических молекул в XVIII веке в результатте работ французского химика Антуана Фуркруа и других учёных, в которых было отмечено свойство белков коагулировать (денатурировать) под воздействием нагревания или кислот. В то время были исследованы такие белки, как альбумин ("яичный белок"), белок из крови, фибрин и глютен из зерна пшеницы . Голландский химик Герхард Мёлдер провёл анализ состава белков и обнаружил, что практически все белки имеют одинаковую эмпирическую формулу. Термин "белок" для обозначения подобных молекул был предложен в 1838 сотрудником Мёлдера Якобом Берцелиусом. Мёлдер также определил продукты разрушения белков - аминокислоты и для одной из них (лейцина) почти точно определил молекулярную массу - 131 Дальтон. Однако центральная роль белков в организмах не была признана до 1926 года, когда американский химик Джеймс Самнер (впоследствии — лауреат Нобелевской премии) показал, что фермент уреаза была белком.
Изучению белков препятствовала сложность их выделения. Поэтому первые исследования белков проводились с использованием тех полипептидов, которые могли быть очищены в большом количестве, т.е. белках крови, куриных яиц, различных токсинах и пищеварительных/метаболических ферментах, которые можно было выделить в местах забоя скота. В конце 1950-х компания Армор Хот Дог К (Armour Hot Dog Co) смогла очистить килограмм бычьей панкреатической рибонуклеазы А, которя стала экспериментальным обьектом для многих учёных.
Идея о том, что вторичная структура белков образуется в результате образования водородных связей между аминокислотами была высказана Уильямом Астбури в 1933, но Лайнус Полинг считается первым учёным, который смог успешно предсказать вторичную структуру белков. Позднее Уолтер Каузман, опираясь на работы Кая Линдерсторма-Лэнга, внёс весомый вклад в понимание законов образования третичной структуры белков и роли в этом процессе гидрофобных взаимодействий. В 1949 Фред Сэнгер определил аминокислотную последовательность инсулина, продемонстрировав таким способом, что белки - это линейные полимеры аминокислот, а не их разветвлённые (как у некоторых сахаров) цепи, коллоиды или циклолы. Первые структуры белков, основанные на дифракции рентгеновских лучей на уровне отдельных атомов были получены в 1960-х и с помощью ЯМР в 1980-х. В 2006 Банк Данных о Белках (Protein Data Bank) содержал около 40 000 структур белков. В настоящее время криоэлектронная микроскопия больших белковых комплексов и предсказание малых белков и доменов больших белков с помощью компьютерных программ по точности приближаются к разрешению структур на атомном уровне.
Структура белка
Молекулы белков представляют собой линейные полимеры, состоящие из 20 основных α-L-аминокислот (которые являются мономерами) и, в некоторых случаях, из модифицированных основных аминокислот (правда модификации происходят уже после синтеза белка на рибосоме). Для обозначения аминокислот в научной литературе используются одно- или трёхбуквенные сокращения.
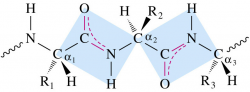
При образовании белка в результате взаимодействия α-аминогруппы (-NH2) одной аминокислоты с α-карбоксильной группой (-СООН) другой аминокислоты образуются пептидные связи. Концы белка называют С- и N- концом (в зависимости от того, какая из групп концевой аминокислоты свободна: -COOH или -NH2, соответственно). При синтезе белка на рибосоме, новые аминокислоты присоединяются к C-концу, поэтому название пептида или белка даётся путём перечисления аминокислотных остатков начиная с N-конца.
Белки длиной от 2 до 100 аминокислотных остатков часто называют пептидами, при большей степени полимеризации - протеинами, хотя это деление весьма условно.
Последовательность аминокислот в белке соответствует информации, содержащейся в гене данного белка. Эта информация представлена в виде поcледовательности нуклеотидов, причем одной аминокислоте соответсвует одна или несколько последовательностей из трех нуклеотидов - так называемых триплетов или кодонов. То, какая аминокислота соответствует данному кодону в мРНК определяется генетическим кодом, который может несколько отличаться у разных организмов.
Гомологичные белки (выполняющие одну функцию и предположительно имеющие общее эволюционное происхождение, например, гемоглобины) разных организмов имеют во многих местах цепи различные аминокислотные остатки, называемые вариабельными, в противоположность консервативным, общим остаткам. По степени гомологии возможна оценки эволюционного расстояния между таксонами.
Простые и сложные белки
Шаблон:Main Выделяют простые и сложные белки. Простые белки содержат только аминокислоты, связанные в цепочку. Сложные белки имеют также неаминокислотные группы. Эти дополнительные группы в составе сложных белков называются «простетическими группами». Многие белки эукариот, например, имеют полисахаридные цепи, которые помогают белку принимать нужную конформацию и придают дополнительную стабильность. Дисульфидные мостики также играют роль как элементы необходимые при принятии белком правильной 3-х мерной формы, и являются главным компонентом сложных белков. Но важно заметить, что в основном только эукариоты способны на синтезирование сложных белков (протеидов), так как прокариоты не имеют достаточно компартментализации для создания дополнительных изменений, присутствующих в сложных белках, и даже если могут это делать в периплазматическом пространстве , то это случается либо редко, либо неэффективно.
Уровни структуры белка
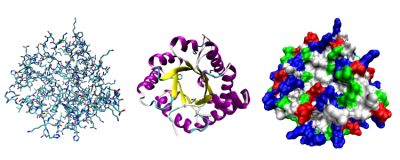
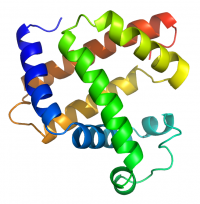
Кроме последовательности аминокислот (первичной структуры), крайне важна трехмерная структура белка, которая формируется в процессе фолдинга (от англ. folding, т.е. сворачивание). Показано, что несмотря на огромные размеры молекул, природные белки имеют лишь одну конформацию, а утратившие структуру белки теряют свои свойства.
Выделяют четыре уровня структуры белка:
- Первичная структура — последовательность аминокислотных остатков в полипептидной цепи. Важными особенностями первичной структуры являются консервативные мотивы - сочетания аминокислот, важных для функции белка. Консервативные мотивы сохраняются в процессе эволюции видов, по ним можно предсказать функцию неизвестного белка.
- Вторичная структура — локальное упорядочивание фрагмента полипептидной цепи, стабилизированное водородными связями и гидрофобными взаимодействиями. Ниже приведены некоторые распространенные типы вторичной структуры белков:
- α-спирали — плотные витки вокруг длинной оси молекулы, один виток составляют 4 аминокислотных остатка, спираль стабилизорована водородными связями между H и O пептидных групп, отстоящих друг от друга на 4 звена. Спираль может быть построена исключительно из одного типа стереоизомеров аминокислот (L или D), хотя она может быть как левозакрученной, так и правозакрученной, в белках преобладает правозакрученная. Спираль нарушают электростатические взаимодействия глутаминовой кислоты, лизина, аргинина, близкорасположенные аспарагин, серин, треонин и лейцин могут стерически мешать образованию спирали, пролин вызывает изгиб цепи и также нарушает α-спирали.
- β-листы (складчатые слои) — несколько зигзагообразных полипептидных цепей, в которых водородные связи образуются между разными цепями, а не внутри одной, как имеет место в α-спирали. Эти цепи обычно направлены N-концами в разные стороны (антипараллельная ориентация). Для образования листов важны небольшие размеры R-групп аминокислот, преобладают обычно глицин и аланин.
- π-спирали;
- <math>3_{10}</math>-спирали;
- неупорядоченные фрагменты.
- Третичная структура
- — пространственное строение полипептидной цепи - взаимное расположение элементов вторичной структуры, стабилизированное взаимодействием между боковыми цепями аминокислотных остатков. В стабилизации третичной структуры принимают участие:
- ковалентные связи (между двумя цистеинами — дисульфидные мостики);
- ионные (электростатические) взаимодействия (между противоположно заряженными аминокислотными остатками);
- водородные связи;
- гидрофобные взаимодействия.
- Четверичная структура
- — субъединичная структура белка. Взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса.
Также выделяют:
- Трёхмерную структуру белка — набор пространственных координат, составляющих белок атомов.
- Cубъединичную (доменную) структуру белка — последовательность участков белка, имеющих известную функцию или определенную трёхмерную структуру.
- Гидрофобное ядро, обеспечивающее сворачивание белка.
Свойства
Размер белка может измеряться в числе аминокислот или в дальтонах (молекулярная масса), чаще из-за величины молекулы производной единице - килодальтонах (кДа). Белки дрожжей, в среднем, состоят из 466 аминокислот и имеют молекулярную массу 53 кДа. Самые большие известные в настоящее время белки, титины, являются компонентом саркомеров мускулов, их молекулярная масса - 3,000 кДа и общая длина 27,000 аа <ref> Шаблон:Cite journal</ref>.
Белки также характеризуются изоэлектрической точкой (pI) - кислотностью среды рН, при которой молекула данного белка не несёт электрического заряда. Например, чем больше в белке гидроксильных (основных) остатков , тем выше его pI. Такой белок называется основным. Белки, связывающиеся с нуклеиновыми кислотами часто относятся к основным белкам. Примером таких белков служат гистоны.
По степени растворимости в воде белки бывают растворимыми (гидрофильные) и нерастворимыми (гидрофобные). К последним относятся большинство входящих в состав биологических мембран интегральных мембранных белков, которые взаимодействуют с гидрофобными липидами мембраны.
.
Денатурация
Шаблон:Main Как правило, белки сохраняют структуру и следовательно физико-химические свойства, например, растворимость в условиях, таких как температура и рН, к которым приспособлен данный организм. Резкое изменение этих условий, например, нагревание или обработка белка кислотой приводит к потере четвертичной, третичной и вторичной структур белка, называемой денатурацией. Самым известный случай денатурации белка - это приготовление куриного яйца, когда под воздействием высокой температуры растворённый в воде, прозрачный белок овоальбумин становится плотным, нерастворимым и непрозрачным.
Денатурация в некоторый случаях обратима, как в случае преципитации водорастворимых белков с помощью солей аммония и используется как способ их очистки.
Синтез белков
Химический синтез
Короткие белки могут быть синтезированы химическим путём с помощью группы методов, которые используют органический синтез, например, химическое лигирование. Большинство методов химического синтеза проходят в направлении от С-конца к N-концу, в противоположность биосинтезу. Таким образом можно получить короткий иммунногенный пептид (эпитоп), необходимый для получения антител путём инъекции в животных или получения гибридом. Химический синтез позволяет вводить искусственные т.е. не встречающиеся в обычных белках аминокислоты, например, присоединять флуоресцентные пробы к боковым цепям аминокислот. Химические методы синтеза неэффективны при длине белков более 300 аминокислот, кроме того, искусственные белки могут иметь неправильную третичную структуру и у аминокислот искусственных белков отсутствуют посттрансляционные модификации.
Биосинтез белков
Шаблон:Main Белки синтезируются живыми организмами из аминокислот на основе информации, закодированной в генах. Каждый белок состоит из уникальной последовательности аминокислот, которая определяется нуклеотидной последовательностью гена, кодирующего данный белок. Генетический код состоит из трёхбуквенных "слов", называемых кодонами, каждый кодон отвечает за присоединение к белку одной аминокислоты, например, АУГ соответсвует метионину. Поскольку ДНК состоит из четырёх типов нуклеотидов, общее число возможных кодонов равно 64, так как в белках используется 20 аминокислот, многие аминокислоты определяются более, чем одним кодоном. Гены, кодирующие белки сначала транскрибируются в последовательность нуклеотидов матричной РНК (мРНК) белками РНК-полимеразами.
У прокариот мРНК может считываться рибосомами в аминокислотную последовательность белков сразу после транскрипции, а у эукариот она транспортируется из ядра в цитоплазму, где находятся рибосомы. Скорость синтеза белков выше у прокариот и может достигать 20 аминокислот в секунду <ref name="Dobson">Dobson CM. (2000). The nature and significance of protein folding. In Mechanisms of Protein Folding 2nd ed. Ed. RH Pain. Frontiers in Molecular Biology series. Oxford University Press: New York, NY.</ref>.
Процесс синтеза белка с мРНК называется трансляцией. Во время начальной стадии биосинтеза белков, инициации, обычно метиониновый кодон, узнаётся малой субъединицей рибосомы, к которой при помощи белковых факторов инициации присоединена метиониновая транспортная РНК (тРНК). После узнавания стартового кодона к малой субъединице присоединяется большя субъединица и начинается вторая стадия трансляции - элонгация. При каждом движении рибосомы от 5' к 3' концу мРНК считывается один кодон путём образования водородных связей между тремя нуклеотидами (кодоном) мРНК и комплементарным ему антикодоном транспортной РНК, которой присоединена соответствующая аминокислота. Синтез пептидной связи катализируется рибосомальной РНК рРНК, образующей пептидилтрансферазный центр рибосомы.Р ибосомальная рРНК катализирует образование пептидной связи между последней аминокислотой растущего пептида и аминокислотой, присоединённой к тРНК, позиционируя атомы азота и углерода в положениии, благоприятном для прохождения реакции. Ферменты аминоацил-тРНК-синтетазы присоединяют аминокислоты к их тРНК. Третья и последняя стадия трансляции, терминация, происходит при достижении рибосомой стоп-кодона, после чего белковые факторы терминации гидролизуют последнюю тРНК от белка, прекращая его синтез. Таким образом, белки всегда синтезируются от N- к C- концу.
Функции белков в организме
Так как и другие биологические макромолекулы (полисахариды, липиды) и нуклеиновые кислоты, белки - необходимые компоненты всех живых организмов, и участвуют в каждом внутреннем процессе клетки. Они являются обязательными компонентами в питании человека и животных, так как не все необходимые аминокислоты могут синтезироваться в организме, и должны поступать из еды. Через процесс пищеварения животные разлагают поглощенные белки при помощи ферментов (также белковой природы) на свободные аминокислоты, которые потом можно использовать для синтезирования белков этого организма.
Белки осуществляют обмен веществ и энергетические превращения. Белки входят в состав клеточных структур — органелл или секретируются во внеклеточное пространство.
Каталитическая функция
Наиболее хорошо известная роль белков в организме - катализ различных химических реакций. Ферменты - группа белков, обладающая специфическими каталитическими свойствами, т.е. каждый фермент катализирует одну или несколько сходных реакций. Ферменты принимают участие в большинстве реакций переваривания сложных молекул анаболизма и их синтеза катаболизма, а также репликации и репарации ДНК и синтезе РНК. Известно несколько тысяч ферментов, среди них, например, пепсин, расщепляет белки в процессе пищеварения. В процесс пострансляционной модификации некоторые ферменты добавляют или удаляют химические группы на других белках. Известно около 4000 реакций, катализируемых белками<ref>Шаблон:Cite journal</ref>. Ускорение реакции в результате ферментативного катализа иногда огромно, например, реакция , катализируемая ферментом оротат-карбоксилазой протекает в 1017 быстрее некатализируемой (78 миллионов лет без фермента, 18 миллисекунд с участием фермента)<ref>Шаблон:Cite journal</ref>. Молекулы, которые изменяются в результате реакции и присоединяемые ферментом, называются субстратами.
Хотя ферменты обычно состоят из сотен аминокислот, только небольшая часть из них взаимодействуют с субстратом, и еще меньшее количество, в среднем 3-4 аминокислоты, часто расположенные далеко друг от друга в первичной аминокислотной последовательности, напрямую участвуют в катализе<ref>The Catalytic Site Atlas at The European Bioinformatics Institute</ref>. Часть фермента, которые присоединяет субстрат и содержит каталитические аминокислоты, называется активным центром фермента.
Структурная функция
Структурные белки, как своего рода арматура, придают форму жидкому внутреннему содержимому клетки. Большинство структурных белков являются филаментозными белками, например, мономеры актина и тубулина - это глобулярные, растворимые белки, но после полимеризации они формируют длинные нити, из которых состоит цитоскелет , который позволяет клетке поддерживать форму. Коллаген и эластин - основные компоненты соединительной ткани, например, хряща, а из другого структурного белка кератина состоят волосы, ногти, перья и некоторые раковины.
.
Защитная функция
Белки, входящие в состав крови, участвуют в защитном ответе организма как на повреждение так и от атаки патогенов. Примерами первой группы белков служат фибриногены и тромбины, участвующие в свёртывании крови, а антитела (иммуноглобулины), нейтрализуют бактерии, вирусы или чужеродные белки. Антитела, входящие в состав адаптативной иммунной системы, просоединяются к чужеродным для данного организма веществам, антигенам и тем самым нейтрализуют их, направляя к местам уничтожения. Антитела могут секретироваться в межклеточное пространство или закреплаться в мембранах специализированных В-лимфоцитов, которые называются плазмоцитами. В то время как ферменты имеют ограниченное сродство к субстрату, поскольку слишком сильное присоединение к субстрату может мешать протеканию катализируемой реакции, стойкость присоединения антител к антигену ничем не ограничено.
Регуляторная функция
Многие процессы в организме регулируются небольшими белковыми молекулами, полипептидными гормонами и цитокинами. Примеры этих белков, соответственно, инсулин, который регулирует концентрацию глюкозы в крови и фактор некроза опухолей, который передаёт сигналы воспаления.
Транспортная функция
Растворимые белки, участвующие в транспорте малых молекул, должны иметь высокое сродство (афинность) к субстрату, когда он присутствует в высокой концентрации и легко его высвобождать в местах низкой концентрации субстрата. Примером транспортных белков служит гемоглобин, который переносит кислород из лёгких к остальным тканям и углекислый газ от тканей к лёгким, а также гомологичные ему белки, найденные во всех царствах живых организмов.
Некоторые мембранные белки участвуют в транспорте малых молекул через мембрану клетки, изменяя её проницаемость. Липидный компонент мембраны водонепроницаем (гидрофобен), что предотвращает диффузию полярных или заряженных (ионы) молекул. Мембранные белки содержат внутренние каналы, которые позволяют таким молекулам перемещаться внутрь или наружу. Многие ионные каналы специализируются на транспорте только одного иона, так калийные и натриевые каналы часто различают эти сходные ионы и пропускают только один из них.
Запасная (резервная) функция белков
К таким белкам относятся так называемые резервные белки, являющиеся источниками питания для развития плода; белки яйца (овальбумины) и основной белок молока (казеин) также выполняют, главным образом, питательную функцию. Ряд других белков несомненно используется в организме в качестве источника аминокислот, которые в свою очередь являются предшественниками биологически активных веществ, регулирующих процессы метаболизма. При полном расщеплении 1 г белка выделяется 17,6 кДж энергии.
Рецепторная функция
Белковые рецепторы могут быть как находящимися в растворе, так и встроенными в клеточную мембрану молекулами. Одна часть молекулы рецептора воспринимает сигнал, который с помощью конформационных изменений передаётся на другую часть молекулы, активирующую передачу сигнала на другие клеточные компоненты. У многих рецепторов часть, молекулы, связывающаяся с сигнальной молекулой (рецептор), находится на поверхности клетки, а домен, передающий сигнал (эффектор) внутри.
Моторная и сократительные функции
Целый класс моторных белков, участвует как в макро-движениях организма, например, сокращении мышц (миозин), так и в активном и направленном внутриклеточном транспорте (кинезин, динеин).
Белки в обмене веществ
Большинство микроорганизмов и растений могут синтезировать 20 стандартных аминокислот, а также две дополнительные каталитические аминокислоты - селеноцистеин и селенометионин. Животные должны получить некоторые из этих аминокислот их пищи.
Основные ферменты в биосинтетических путях, например, аспартаткиназа, которая катализирует первый этап в образовании лизина, метионина и треонина из аспартата, отсутствуют у животных. Аминокислоты, которые не могут быть синтезированы этими организмами, называются незаменимыми. Но если аминокислоты есть в окружающей среде, даже микроорганизмы сохраняют энергию путём транспорта аминокислот внутрь клеток и выключения их биосинтетических путей.
Животные получают аминокислоты из белков, содержащихся в пище. Белки разрушаются в процессе пищеварения, который обычно начинается с денатурации белка путём помещения его в кислотную среду и гидролиза с помощью ферментов, называемых протеазами. Некоторые аминокислоты, полученные в результатае пищеварения, используются для синтеза белков организма, а остальные превращаются в глюкозу в процессе глюконеогенеза или используются в цикле Кребса. Использование белка в качестве источника энергии особенно важно в условиях голодания, когда собственные белки организма, в особенности мускулов, служат источником энергии. Аминокислоты также являются важным источником азота в питании организма.